瑞德西韋臨床試驗結果來了
原標題:瑞德西韋臨床試驗結果來了!“明星藥”療效如何?
中新網客戶端北京4月12日電(記者 張尼)新冠肺炎疫情在全球蔓延態勢引發擔憂。對疫情進行防控的同時,人們更寄希望於特效藥的成功研發,以救治龐大的感染人群。
此前,美國吉利德科學公司的在研藥物瑞德西韋一直被寄予厚望。
近日,一份瑞德西韋在同情用藥情況下治療重症患者的試驗結果公布。數據顯示,68%的重症患者在使用瑞德西韋后症狀有所緩解。但吉利德方面也強調,同情用藥的數據存在局限性。
吉利德科學董事長兼首席執行官Daniel O’Day發布公開信。(圖片來源:吉利德科學官網截圖)
臨床試驗結果出爐:同情用藥結果存在局限性
當地時間4月10日,《新英格蘭醫學雜志》(NEJM)刊發了瑞德西韋在同情用藥情況下治療重症新冠肺炎患者的試驗結果。
試驗結果表明,53名來自全球的重症新冠肺炎患者在使用瑞德西韋后,36名患者(68%)的症狀有所緩解。
在氧支持情況方面,此前接受機械通氣治療的30名患者中,17名(57%)不再需要插管﹔4名原先需要ECMO支持的患者中,3名(75%)不再使用ECMO。
在死亡率方面,53名患者中共有7名患者(13%)死亡。其中,34名此前接受有創通氣的患者中,有6名患者死亡,死亡率為18%﹔19名未接受有創通氣的患者中,1名患者死亡,死亡率為5%。
在藥物安全性方面,共有32名患者(60%)出現了副作用,最常見的是肝酶升高、腹瀉、皮疹、腎損傷和低血壓﹔共有12名患者(23%)出現了嚴重副作用,包括多器官功能障礙綜合征、感染性休克、急性腎臟損傷和低血壓。
“目前仍然沒有被証實有效的新冠肺炎治療方法。”論文作者、洛杉磯雪鬆西奈山醫療中心醫院流行病學主任Jonathan D. Grein說,“我們無法從這些數據中得出瑞德西韋明確有效的結論,但這組接受瑞德西韋治療的住院患者的觀察結果是有希望的。我們期待著對照的臨床試驗結果能夠潛在地驗証這些發現。”
美國時間4月10日,針對瑞德西韋的研究進展,吉利德科學董事長兼首席執行官Daniel O’Day也發布了一封公開信。
他在信中強調:“我們知道,單純從研究角度來看,這些同情用藥的數據存在局限性,然而,我們也知道這些數據對於獲得了症狀改善的患者來說有著非常大的意義。這53名患者的早期數據並非通過臨床試驗獲得,且數據隻覆蓋了少數接受瑞德西韋治療的危重患者。”
中國重症臨床試驗已停止
瑞德西韋是一種核苷類似物,原用於抗埃博拉病毒感染的臨床試驗。一些體外及動物研究顯示,一定濃度下該藥可對嚴重急性呼吸綜合征(SARS)冠狀病毒和中東呼吸綜合征(MERS)冠狀病毒起到抑活作用。
作為一種在研藥物,瑞德西韋尚未在世界上任何國家獲得批准。基於“同情用藥”原則,美國研究人員今年1月對一名新冠肺炎患者使用了瑞德西韋,患者症狀在一兩天內顯著改善,使這種藥物備受關注。
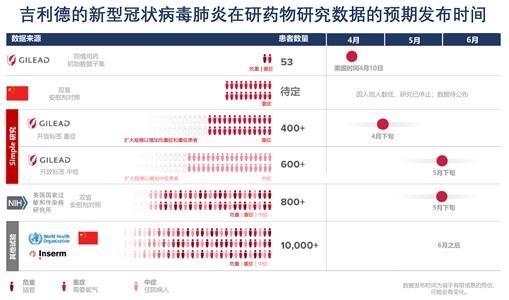
據吉利德方面介紹,目前,瑞德西韋的臨床試驗有七項臨床試驗已經啟動,以確定瑞德西韋治療新型冠狀病毒肺炎的安全性和有效性。
中國在二月初啟動了最早的兩項對重症和中症患者的研究。此后,新增的五項試驗在世界各地啟動。
中國國家知識產權局此前曾介紹稱,中國在武漢的多家醫院開始了該藥物的臨床試驗,要到4月27日才能公布臨床試驗的結果。
不過此后有媒體報道稱,瑞德西韋在中國的臨床試驗面臨“入組患者不足”的問題。除了病人減少,以及瑞德西韋在臨床試驗上設置門檻較高外,大量新冠肺炎相關的臨床試驗在中國臨床試驗注冊中心上登記,“分流”了患者資源。
在吉利德董事長10日發布的這封公開信中提到:中國的研究者將負責發布瑞德西韋在中國的試驗數據,但是,我們已獲悉,因入組停滯,針對重症患者的研究已停止。
“我們期待在適當的時候看到公布的數據。我們預計五月份獲得有安慰劑對照的NIAID試驗的初步數據,以及吉利德的針對中度症狀新型冠狀病毒肺炎患者的研究數據。”
圖片來源:吉利德科學官網
吉利德:已將生產全程時間縮短到約六個月
瑞德西韋在全球范圍內的臨床試驗仍在繼續開展。
據媒體此前報道,全球瑞德西韋臨床試驗做了一些與中國不同的設計,或可降低試驗難度,避免患者招募難的問題。
據吉利德方面介紹,吉利德正在美國、亞洲和歐洲的新型冠狀病毒肺炎高發地區進行兩項三期研究。其中一項研究針對重症患者,另一項研究針對中症患者。這些研究要回答的眾多問題之一是治療時間是否可以從10天縮短到5天。
“重症的入組患者人數已達到了最初設計要求的人數,我們現在已經擴大了研究范圍,讓包括接受機械通氣的患者在內的更多患者可以參與其中。”Daniel O’Day在10日發布的公開信中提到。
此外,美國國家過敏和傳染病研究所(NIAID)於2月21日開始了一項全球試驗。該試驗將隨機分配患者使用瑞德西韋或安慰劑,以對照比較試驗結果。該試驗正在入組約800名具有不同症狀的患者。
在審批方面,今年3月,美國食品藥品監督管理局(FDA)公告稱,批准了針對治療新冠潛在有效藥物瑞德西韋的孤兒藥認証,適應症為新型冠狀病毒肺炎(COVID-19)。
不過,此事引發了不少爭議,一些業內人士擔心,孤兒藥資格可能會影響瑞德西韋的可及性。
隨后,吉利德發布聲明宣布已經向FDA提出申請,要求FDA撤銷瑞德西韋的孤兒藥資格認証,並放棄與孤兒藥資格相關的所有權益。
另一方面,吉利德方面已經迫不及待擴大產能。
Daniel O’Day本月4日曾發表公開信強調,已將瑞德西韋的生產全程時間從大約一年減少到約六個月。
他還強調,吉利德正力爭到10月份生產超過可供50萬個療程使用的藥品,到今年年底的可供應量要超過100萬個療程。

資料圖:當地時間3月23日,意大利米蘭東南部的克雷莫納醫院重症監護室,醫護人員正在為感染新冠狀肺炎的重症患者治療。
全球加緊尋求有效治療方法
如今,新冠肺炎疫情在全球蔓延態勢依舊嚴峻。
美國約翰斯·霍普金斯大學實時統計數據顯示,截至北京時間4月11日17時45分,全球新冠肺炎確診病例超過170萬例,死亡病例超10萬例。
除了被寄予厚望的瑞德西韋,目前,其他藥物的研發與試驗也在推進中。
美國國家衛生研究院(NIH)9日宣布啟動一項針對抗瘧疾藥——羥氯喹的臨床試驗。這項評測旨在研究其治療新冠肺炎患者的安全性和有效性。
研究由NIH下屬的國家心肺血液研究所(NHLBI)進行,首批參與臨床試驗的患者正在美國田納西州范德堡大學醫學中心登記。